HNO3 là gì? HNO3 được biết đến trong thực tế với tính axit và oxy hóa mạnh, đây là một chất hóa học được sử dụng phổ biến trong đời sống hiện nay. Vậy, cụ thể HNO3 là gì? Những đặc điểm và tính chất của axit nitric là gì? Cách điều chế HNO3 ra sao? Trong bài viết này, hãy cùng Công ty Thiên Đại Phúc xem qua thông tin để có câu trả lời.

Trước khi tìm hiểu về cách điều chế HNO3, hãy cùng xem qua khái niệm axit nitric là gì?
HNO3 là gì?
Axit nitric (axit nitric khan) là hợp chất vô cơ có công thức hóa học HNO3 được hình thành trong tự nhiên, do trong những cơn mưa kèm sấm và sét tạo thành. HNO3 là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, đây được xem là một trong những chất axit độc, ăn mòn và dễ gây cháy.

Vậy, cách điều chế HNO3 như thế nào, hãy cùng xem tiếp thông tin bên dưới.
Đặc điểm và tính chất của HNO3 là gì?
Công thức cấu tạo của HNO3
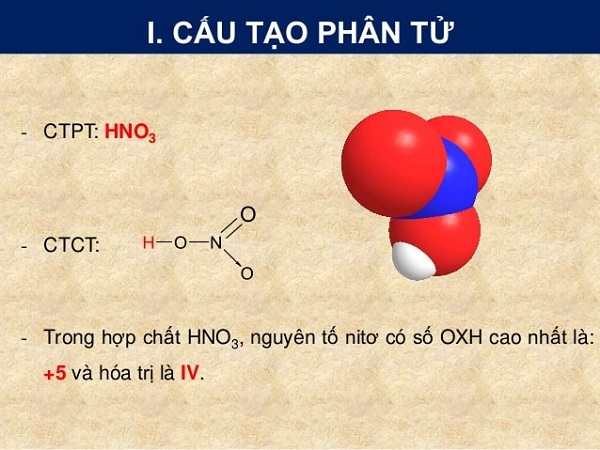
***Tham khảo thêm: Hóa chất Amoniac - NH4OH
Tính chất vật lý
Axit nitric là một chất lỏng trong suốt không màu, đây được xem là một nguyên liệu quan trọng và sử dụng phổ biến.
|
Công thức hóa học |
HNO3 |
|
Khối lượng phân tử |
63.012 g.mol −1 |
|
Ngoại quan |
Chất lỏng bốc khói không màu, vàng hoặc đỏ khi ở ngoài môi trường. |
|
Mùi |
vị chát, ngột ngạt |
|
Tỷ trọng |
1.51 g/cm3, 1.41g/cm3 |
|
Độ nóng chảy |
-42°C (−44°F; 231K) |
|
Điểm sôi |
83°C (18°F, 356K) |
|
Độ hòa tan trong nước |
Hoàn toàn có thể trộn được |
|
Áp suất hơi |
48 mmHg (20°C) |
|
Độ axit (pKa ) |
-1.4 |
|
Cơ sở liên hợp |
Nitrat |
|
Nhạy cảm từ (χ) |
1.99 × 10−5 cm3/mol |
|
Chỉ số khúc xạ (nD) |
1.394 (16.5°C) |
|
Khoảnh khắc lưỡng cực |
2.17 ± 0.02 D |
Bảng tính chất vật lý của axit nitric
Tính chất hóa học
Axit nitric là một dung dịch nitrat hydro, là một axit khan, có tính oxi hóa mạnh, có hằng số cân bằng axit (pKa) = −2.
Quỳ tím chuyển sang màu đỏ
Axit nitric có thể làm quỳ tím chuyển sang thành màu đỏ.
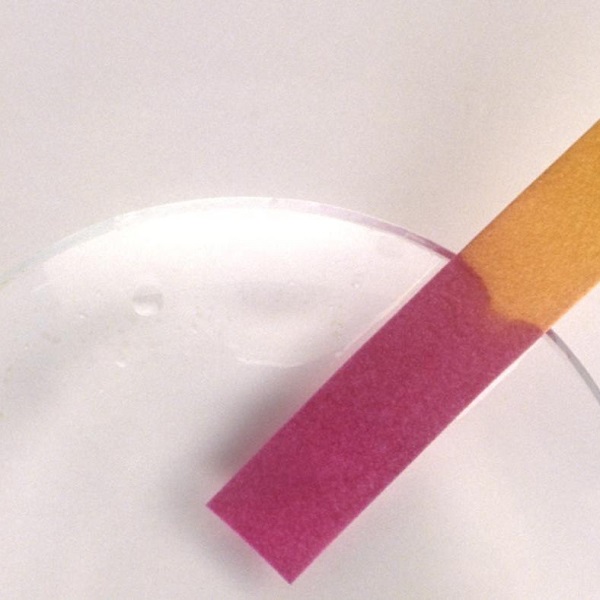
Tác dụng với bazơ, oxit bazơ, muối cacbonat tạo thành muối nitrat và nước
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
HNO3 tác dụng với kim loại (trừ Au và Pt) tạo thành muối nitrat và nước
Phương trình kim loại tác dụng với HNO3 như sau:
Kim loại + HNO3 đặc → muối nitrat + NO + H2O
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Lưu ý: Fe, Al, Cr bị thụ động hóa trong HNO3 đặc, nguội.
Tác dụng với phi kim
Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nitơ đioxit với phương trình:
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2O
Tác dụng với hợp chất
HNO3 có khả năng phá hủy nhiều hợp chất hữu cơ, có thể gây nguy hiểm nếu axit này tiếp xúc với cơ thể người.
3H2S + 2HNO3 (>5%) → 3S (kết tủa) + 2NO + 4H2O
PbS + 8HNO3 (đặc) → PbSO4 (kết tủa) + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không phản ứng với HNO3.
Sau khi tìm hiểu về tính chất hóa học, tiếp theo hãy cùng xem qua cách điều chế HNO3.
Phương pháp điều chế axit nitric (HNO3)
Có thể điều chế HNO3 phòng thí nghiệm hoặc trong công nghiệp bằng cách sau:
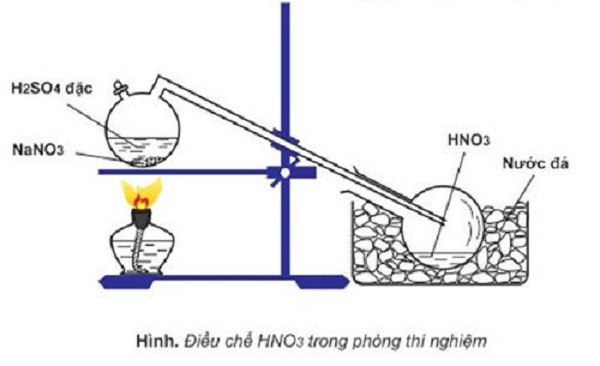
Trong phòng thí nghiệm
Điều chế HNO3 trong phòng thí nghiệm bằng cách cho đồng (II) nitrat hoặc cho phản ứng những khối lượng bằng nhau kali nitrat (KNO3) với axit sunfuric (H2SO4) 96%, và chưng cất hỗn hợp này tại nhiệt độ sôi của HNO3 là 83 °C cho đến khi còn lại chất kết tinh màu trắng.
H2SO4+ NaNO3 (tinh thể) → HNO3 + NaHSO4
Trong công nghiệp
HNO3 loãng có thể cô đặc đến 68% axit với hỗn hợp azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiếp tục chưng cất với axit sunfuric H2SO4 - đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Phương pháp điều chế HNO3 kể trên đã giúp quý khách có cái nhìn tổng quan hơn về HNO3.
>>> XEM NGAY: Nơi phân phối hóa chất HNO3 (Axit nitric) 68% chính hãng, uy tín

Lợi ích và tác hại của axit nitric trong đời sống
Lợi ích
-
HNO3 được sử dụng phổ biến trong điều chế thuốc nổ như nitroglycerin hay các RDX.
-
Axit nitric dùng chủ yếu để sản xuất phân đạm, các muối nitrat ngành phân bón như KNO3, Ca(NO3)2,…
-
HNO3 được dùng khá phổ biến trong điều chế các muối nitrat trong phòng thí nghiệm cũng như trong cuộc sống.
-
Ứng dụng rộng rãi trong ngành công nghiệp xi mạ, luyện kim vì phản ứng hầu hết với các kim loại trong các hợp chất hữu cơ.
-
Sử dụng trong chế tạo thuốc nhuộm vải, len, sợi,…
-
Ứng dụng trong xử lý nước để loại bỏ tạp chất, cân bằng lại độ tiêu chuẩn của nước.
-
HNO3 sử dụng để điều chế, làm chất xúc tác, làm thuốc thử để phân biệt một số hóa chất trong phòng thí nghiệm.
Tác hại
-
Hít phải: Làm tổn thương hệ hô hấp.
-
Nuốt phải: Gây bỏng nặng các cơ quan thực quản, trường hợp nhẹ có thể gây nôn ói, tiêu chảy hoặc gây tử vong.
-
Dây vào mắt: Gây tổn thương giác mạc, có thể mù lòa.
-
Tiếp xúc với da: Gây phỏng da.
Những lưu ý cần biết khi sử dụng axit nitric
Một số lưu ý khi sử dụng HNO3:
-
HNO3 là chất oxy hóa mạnh, khi tác dụng với cyanit, bột kim có thể phát nổ và tự bốc cháy khi phản ứng với turpentine.
-
Khi pha loãng, tuyệt đối không được đổ nước vào axit mà phải thực hiện ngược lại là cho axit vào nước.
-
Ở nồng độ đậm đặc có thể gây bỏng da.
-
Sử dụng các thùng chứa bằng nhựa thay cho kim loại vì HNO3 không tác dụng với chất liệu này.
-
Các thùng chứa HNO3 phải đậy nắp kín, tránh ánh nắng mặt trời.
-
Khu vực lưu trữ HNO3 phải thoáng mát và tránh xa các nguồn nhiệt.
-
Nền nhà phải có khả năng chống được axit.
Hy vọng những thông tin về cách điều chế HNO3 và những ứng dụng thực tế của HNO3 trong đời sống đã giúp quý khách có thêm thông tin hữu ích. Nếu quý khách đang có ý định mua hóa chất hay thông tin thắc mắc hãy liên hệ Công ty Thiên Đại Phúc để được tư vấn.
THÔNG TIN LIÊN HỆ
CÔNG TY TNHH THIÊN ĐẠI PHÚC
- Văn phòng: 61S1 Lê Thị Vân, KDC An Bình, P. An Bình, Biên Hòa, Đồng Nai
- Hotline: 0932787898
- Mail: info@hoachatthiendaiphuc.com.vn
- Website: http://hoachatthiendaiphuc.com.vn/
***Xem thêm các loại hóa chất công nghiệp khác:
Tin tức khác
- Giảm thuế thu nhập doanh nghiệp xuống 20% (29-11-2017)
- Doanh nghiệp sản xuất, kinh doanh phân bón gặp khó (29-11-2017)
- Tại sao lịch nghỉ Lễ 2/9 năm 2023 được nghỉ 4 ngày? (19-07-2023)
- Top 7 loại hóa chất dệt nhuộm phổ biến nhất hiện nay giá tốt (21-01-2022)
- Hoá chất công nghiệp là gì? Phân loại và ứng dụng trong đời sống (20-01-2022)
- Các loại hóa chất xử lý nước thải phổ biến trong công nghiệp (05-01-2022)
- Tổng hợp các loại dung môi pha sơn công nghiệp tốt nhất hiện nay (02-11-2021)
- 5 cách làm nước rửa chén tại nhà - Công thức pha chế chuẩn (02-11-2021)










